

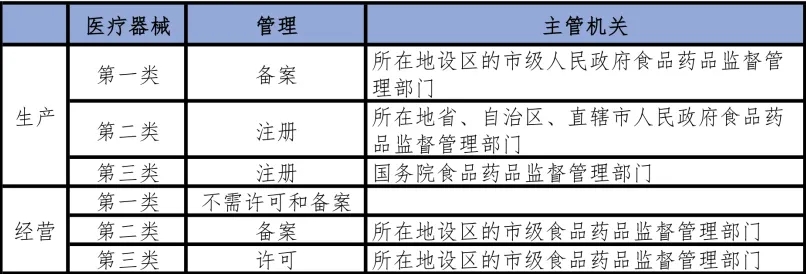
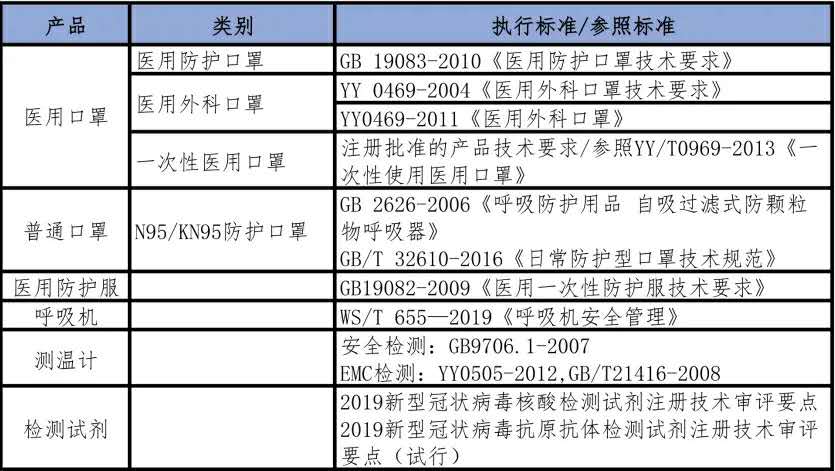
表三 防疫物資產品標準
2.國外標準
產品在國內生產後,若想出口至其他國家或地區,還需滿足出口目的地的標準。下表四至七總結了部分國家的防疫物資生產標準供國內企業參考,建議國內企業在進行貿易時務必和國外買家確認當地產品標準,以減少國際貿易過程中的風險。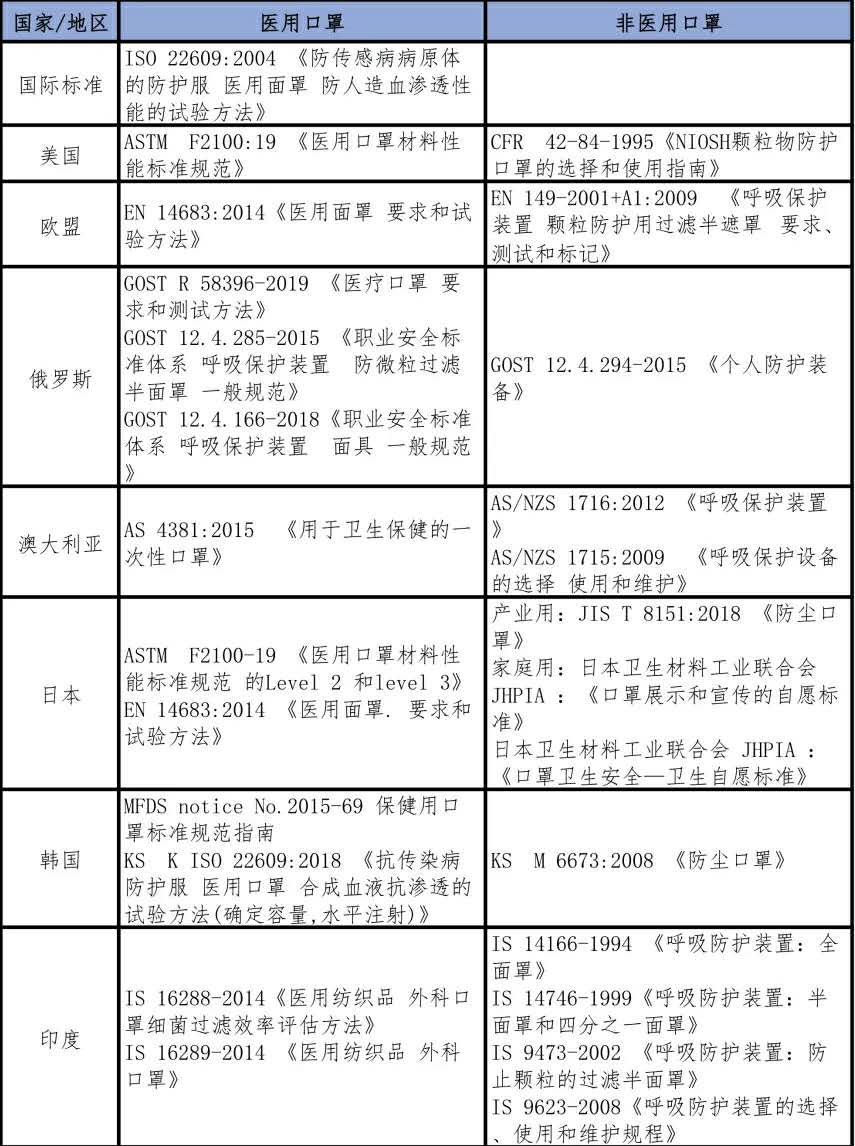
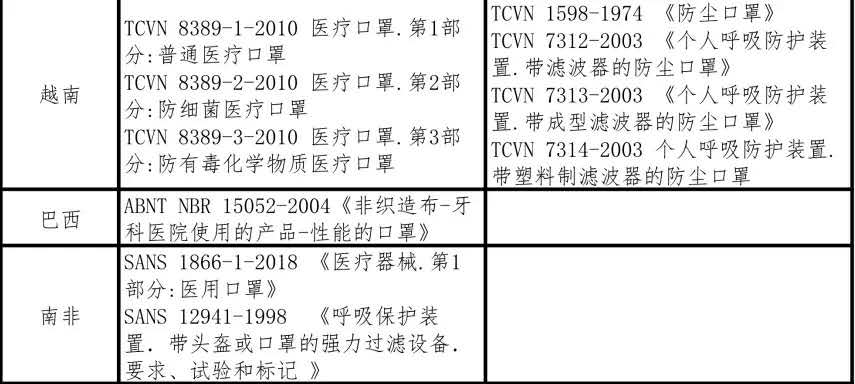
表四 外國醫用口罩及非醫用口罩生產標準
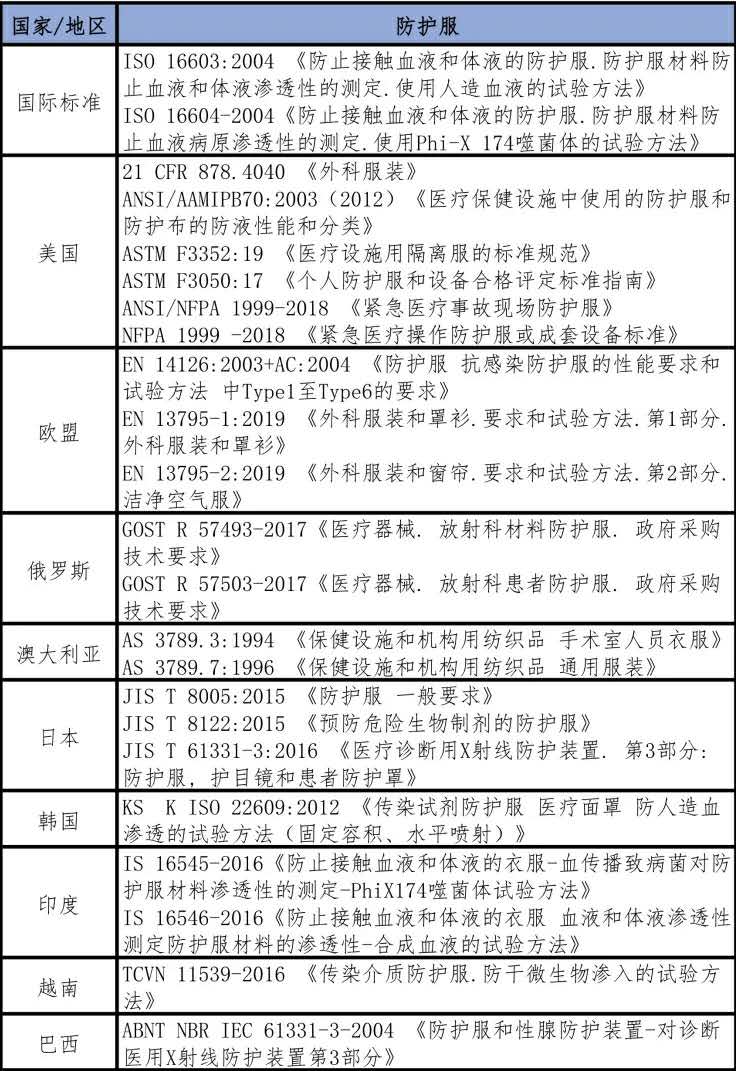
表五 外國防護服生產標準
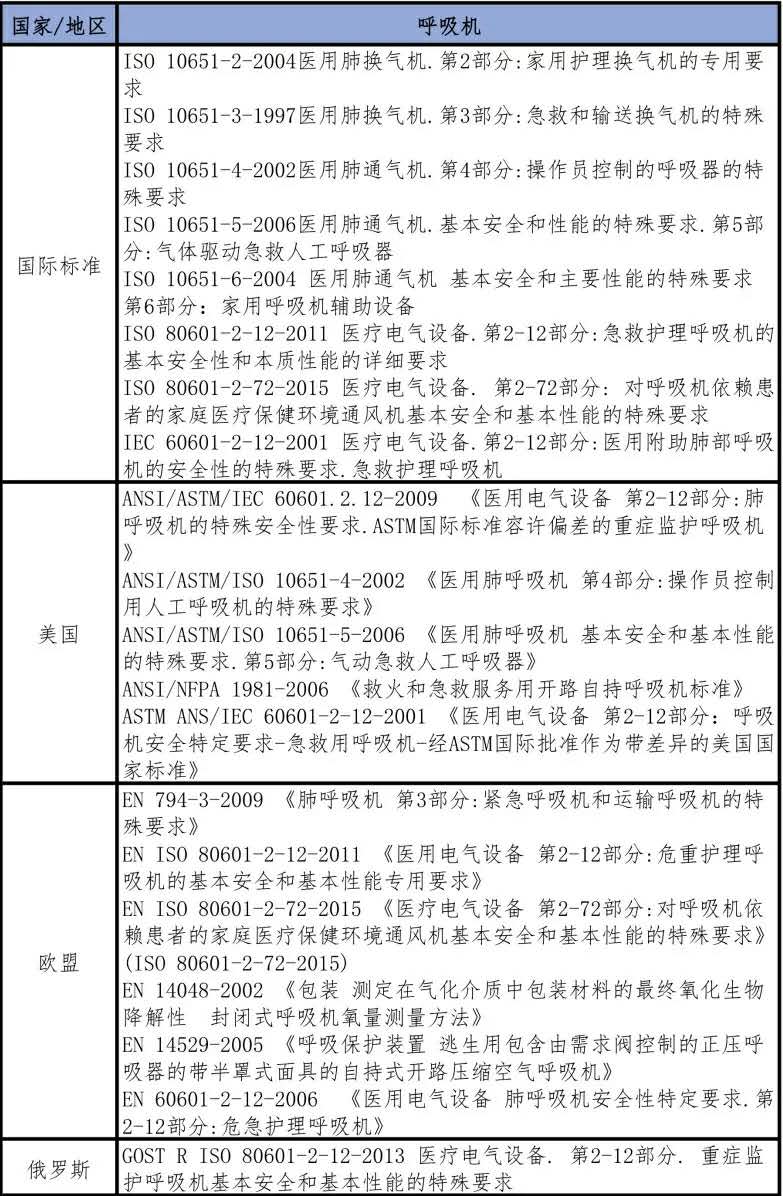

表六 外國呼吸機生產標準
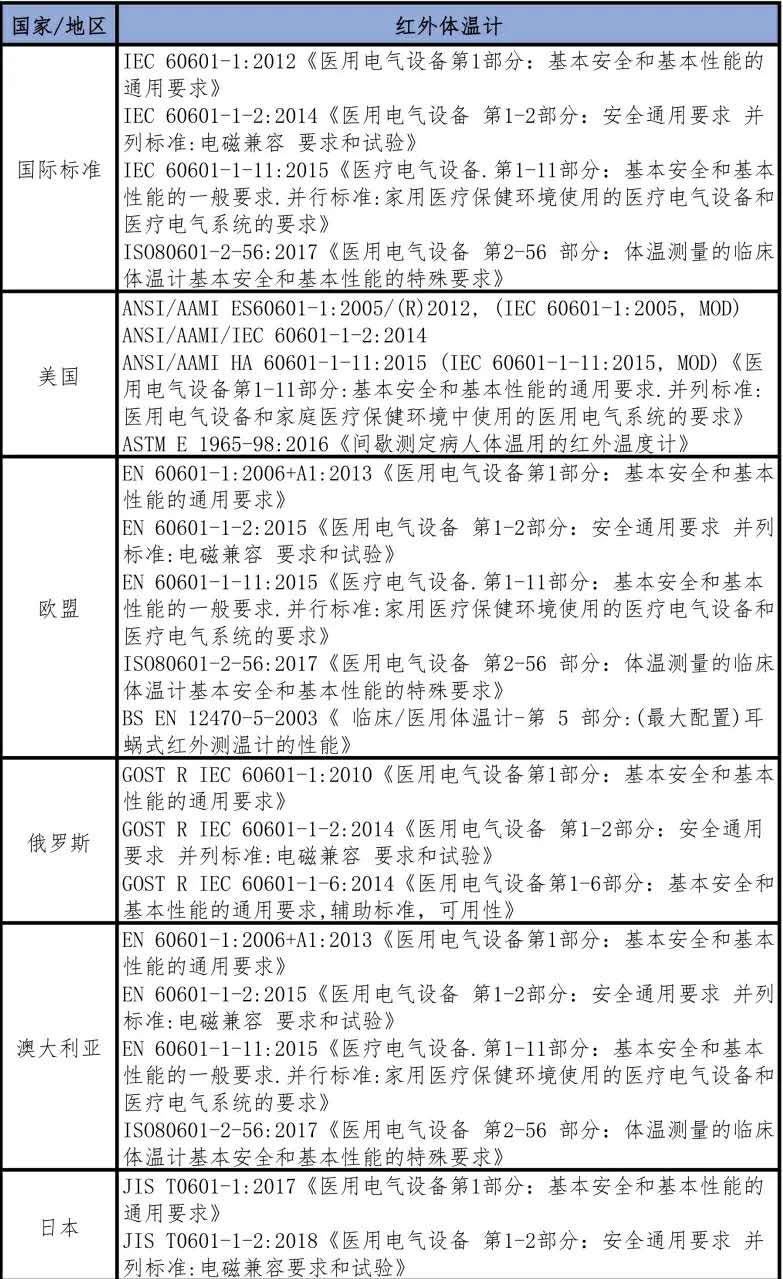
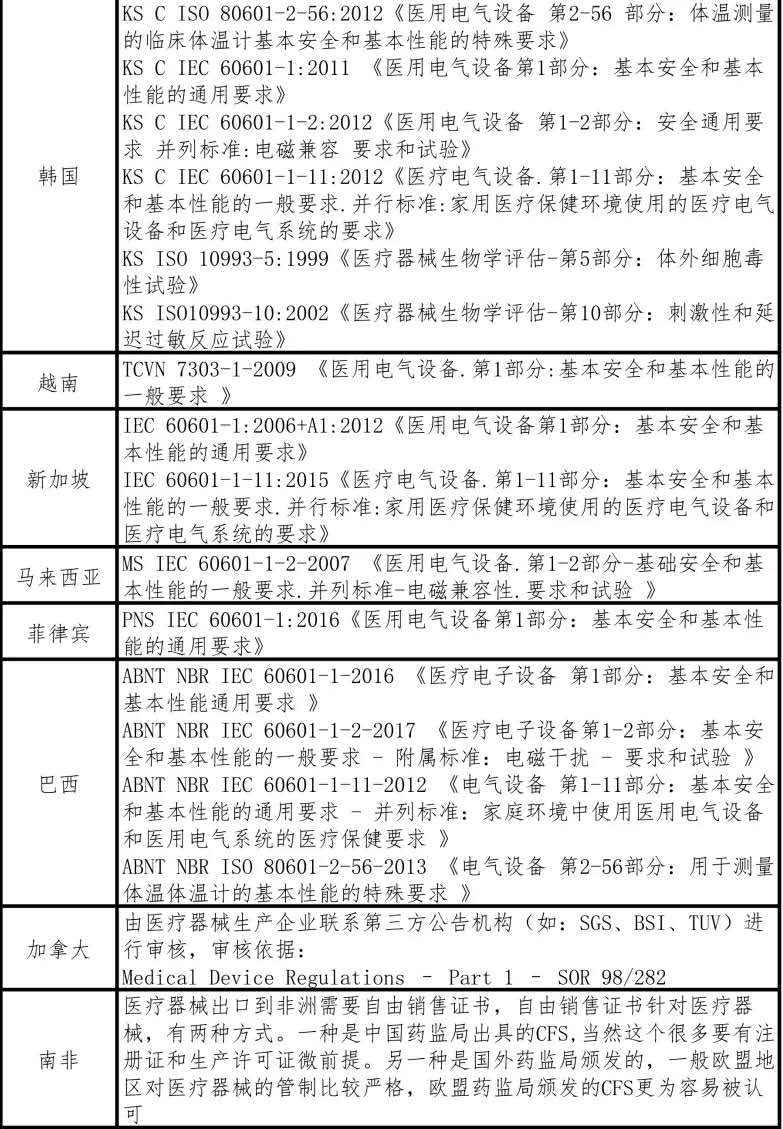
表七 外國紅外體溫計生產標準
據路透社報道,美國貿易代表處3月12日宣布,不對部分從中國進口的醫藥品加征關稅。這些醫藥品包括口罩、聽診器、血壓計袖帶等。此前美國貿易代表處已將洗手液、醫用手套等進口產品移出征稅清單。
(2)緊急使用授權——EUA
針對口罩的EUA
2020年4月3日,美國食品藥品監督管理局(Food and Drug Administration, FDA)簽發了針對中國生產的未獲NIOSH認證的呼吸器(口罩)獲得EUA緊急授權的文件,無須FDA介入的PPE類型,EUA申請可提交至FDA進行審查,以簡化流程,縮短拿到批準的時間。
在中國制造的一次性無NIOSH批準的口罩若符合以下其中一項認證標準,即符合本EUA的授權條件:
1)由擁有一個或多個NIOSH認證產品的制造商,按照其他國家/地區的適用授權標準生產的其他型號的過濾式面罩呼吸器(FFR),FDA可以進行驗證;
2) 中國以外的其他地區授權的,FDA可以進行驗證;
3)有獨立的測試實驗室出具的檢測報告,能顯示其產品性能符合適用的測試標準的,FDA可以進行驗證。
註:如果符合這個原則,按照中國標準設計和驗證的口罩的制造商是可以獲得EUA授權的。
FDA還簽發了關於呼吸機、試劑盒等醫用診療物資的EUA,目前國內已有數家生產、銷售呼吸機、試劑盒的企業獲得FDA的EUA資質認可。
2.歐盟
2020年3月13日,歐盟委員會在歐洲官方雜誌(Official Journal of the EuropeanUnion)發布了疫情期間針對醫療器械(包括外科口罩、醫用檢查手套和隔離服)和個人防護用品(包括口罩、防護手套、全身防護服、防護鏡)的合格評定和市場監管程序的建議(Commission Recommendation (EU) 2020/403,不具有法律約束力,僅僅是為歐盟法規的解釋提供一個指引、建議和說明)。該建議中的重點內容總結如下:
(1)醫療器械(medical device, MD)
1)如未完成合格評定程序,市場監督機構確定產品符合醫療器械的基本安全和性能要求,產品可在一定時間內進行銷售,同時繼續完成其合格評定過程。
2)如沒有CE標誌,由官方或授權機構采購,僅可提供給醫療工作者使用,不能在市場上流通銷售,由市場監督部門進行抽查。
(2)個人防護用品(personal protective equipment, PPE)
1)如未完成合格評定程序,市場監督機構確定產品符合PPE法規的基本健康和安全要求,產品可在一定時間內進行銷售,同時繼續完成其合格評定過程。
2)如采用與PPE法規基本健康與安全要求同等水平的技術要求(例如WHO推薦要求),公告機構發證,並立即通知主管當局和其它PPE法規的公告機構。
3)如沒有CE標誌,由官方或授權機構采購,僅可提供給醫療工作者使用,不能在市場上流通銷售,由市場監督部門進行抽查。
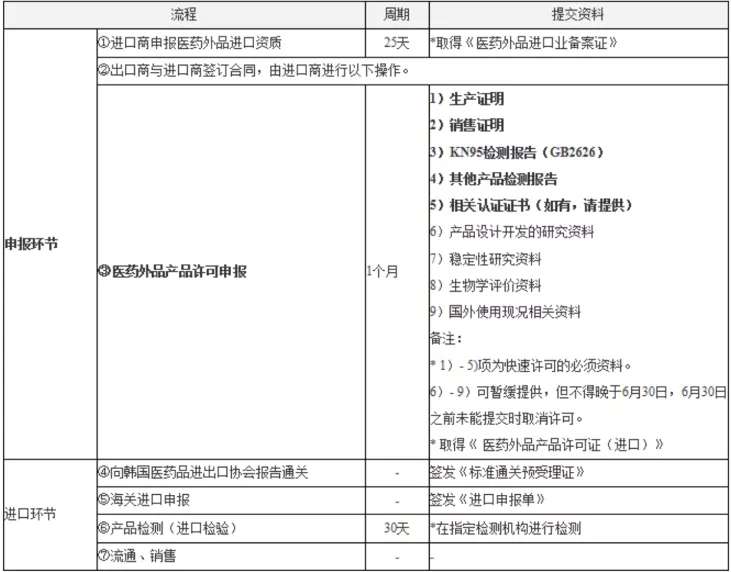
3.韓國
依據食品醫藥品安全處應對新冠病毒支援部發布的最新消息,醫藥輔助類口罩,保健用(包括手術用)口罩,用於非商業用途的救助、捐贈及企業發放給職員時,可申請產品免檢,需提交申請書和使用計劃書,可以迅速進口。
用於商業銷售類口罩產品可進行快速許可,許可審查部門的聯系方式如下:
首爾地方食藥廳醫藥品安全管理科02-2640- -1413
釜山地方食藥廳醫療產品安全科051-602-6187
京仁地方食藥廳醫療產品安全科02-2110-8097、8072
大邱地方食藥廳醫療產品安全科053-589-2757
光州地方食藥廳醫療產品安全科062- 602-1541, 1455
大田地方食藥廳醫療產品安全科042-480-8768
(聯系以獲取進口業務報關單和產品授權書,並迅速處理進口要求。)
俄羅斯政府簡化了36種醫療器械的註冊程序,包括呼吸器,醫用口罩,隔熱服和防護服以及手套和鞋套。俄羅斯衛生監督局將在收到初始註冊申請資料後的五天內做出註冊決定。之後制造商將需在五個月內確認註冊產品的安全性和質量。如果資料與聲明的參數不一致,則註冊將被取消。
目前歐亞經濟委員會發布消息稱,將對用於預防新冠肺炎病毒傳播的商品進口臨時實施零關稅。零關稅進口政策涉及2020年3月16日-9月30日進口到歐亞經濟聯盟境內的醫療物資,包括口罩、醫用手套、消毒劑等。
5.沙特阿拉伯
為了確保沙特有足夠的醫療設備和所需產品供應,現已采用以下新的監管幹預措施:
(1)進口個人防護用品(PPE)
SFDA會加快評估過程,並在確保其安全後的兩個工作日內簽發醫療個人防護設備(PPE)的醫療設備銷售許可(MDMA),例如醫用口罩,醫用手套和一次性防護服。在通過MDMA完成註冊之前,可以向發行公司提供臨時進口許可證,當沒有醫療口罩時,醫療服務提供者可以在緊急情況下使用N95口罩。
(2)當地未經授權的個人防護設備(PPE)工廠
組織SFDA代表團隊進行審核訪問,以確保原材料和整個制造過程的安全性和質量。如果生產過程的安全性和質量是可接受的,將在緊急危機期間頒發臨時許可證。制造商應稍後在SFDA註冊並滿足所有制造要求,包括獲得授權機構的ISO 13485認證。
(3)IVD kits(體外診斷試劑盒)的緊急進口許可
SFDA正在為專門用於新型冠狀病毒(COVID-2019)的IVD試劑盒(用於研究用途)簽發緊急批準和進口許可。
